Cytotoxické T lymfocyty (dále také TC, CD8+ T buňky, CD4– T buňky) jsou typem bílých krvinek podílejích se na imunitní odpovědi organismu. Zaměřují se na ochranu organismu před intracelulárními patogeny, včetně virů, bakterií a parasitů, které se rozmnožují uvnitř hostitelské buňky. V ideálním případě donutí cytotoxické lymfocyty napadené hostitelské buňky k buněčné smrti dříve, než se z nich patogeny mohou dostat do prostředí.
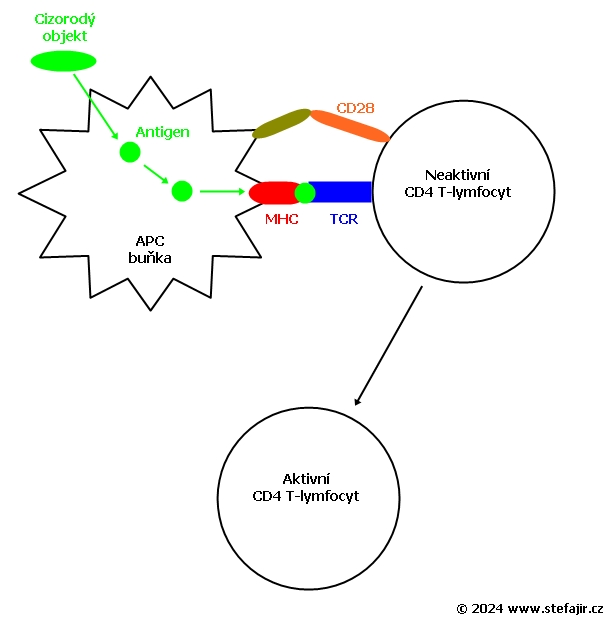
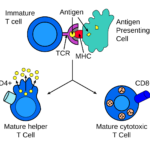
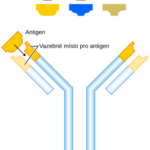
Na membránách cytotoxických T lymfocytů se nachází proteiny (TCR), které se mohou vázat na specifický antigen. Antigeny jsou prezentovány na membránách všech tělu vlastních buněk proteiny MHC typu I. Pokud se při kontaktu cytotoxického T lymfocytu a kontrolované buňky TCR receptory naváží na presentované antigeny, je to pro lymfocyt signál k likvidaci dané buňky.
Samotná afinita TCR ke specifickému proteinu je však relativně malá a pro funkci lymfocytu nedostačující – proto je třeba podpůrný protein zvaný CD8. Ten se naváže na konstantní část MHC typu I. Afinita mezi CD8 a MHC „přidrží“ lymfocyt a cílovou buňku pevněji u sebe během antigen-specifické aktivace. Odtud tedy název CD8+ T buňky.
Vývoj
Imunitní systém musí rozpoznat miliony potenciálních antigenů. V lidském genomu je však méně než 30 000 genů, tudíž mít pro každý antigen odpovídající gen není možné. Z toho důvodu je genetická informace v buňkách lymfocytů rekombinována, aby mohly být vytvořeny nové buňky s unikátními receptory schopnými vázat co největší množství antigenů. Rekombinací nicméně může dojít i k vytvoření buněk s afinitou k tělu vlastním antigenům. Aby nedocházelo ke vzniku autoimunitních onemocnění, prochází lymfocyty selekcí.
Lymfocyty se vyvíjejí z hematopoetických kmenových buněk, které migrují z kostní dřeň do brzlíku. Juvenilní lymfocyty, vyvíjející se v brzlíku, se nazývají tymocyty. Podle typu TCR proteinu jsou rozlišitelné 2 typy lymfocytů. TCR má vždy dva řetězce, obvykle alfa-beta a v malé menšině buněk (cca 5 %) gama-delta. Funkce dospělých lymfocytů se bude lišit podle typu TCR – lymfocyty s alfa-beta řetězcem se specializují na proteinové antigeny, lymfocyty s gama-delta řetězcem se nacházejí v epiteliálních buňkách (třeba ve střevě).
DN fáze vývoje
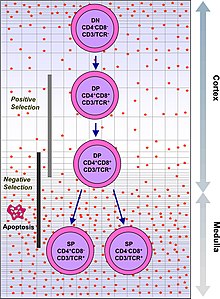
V prvních fázích vývoje tymocyty postrádají CD4 i CD8 proteiny a jsou to takzvaně „double negative“ (DN) buňky. Různá stádia vývoje tymocytů rozlišujeme podle přítomnosti CD44 a CD25 molekul. DN1 buňky jsou nejmladšími tymocyty. Typicky jsou CD44 pozitivní a CD25 negativní. DN2 buňky jsou již i CD44+ i CD25+.
Ve stadiu DN3, kdy je tymocyt CD44- a CD25+ dochází k rekombinaci beta řetězce. Tymocyty pak procházejí tzv. beta selekcí, při které jsou vybírány ty buňky, které úspěšně naváží vlákno substituující alfa řetězec (pre-Tα). Pokud tato interakce proběhne úspěšně, znamená to, že rekombinace beta řetězce proběhla v buňce tak, jak měla, a vznikne tzv. pre-TCR komplex. Buňky s tímto komplexem se dostávají do fáze DN4, jsou CD44- i CD25– a již nerekombinují beta řetězec, ale přežívají, proliferují a začínají exprimovat CD4 a CD8 proteiny.
DP fáze vývoje

Buňky exprimující CD4 i CD8 jsou takzvaně „double positive“ (DP). U DN3 buněk neschopných navázat pre-Tα nastává buněčná smrt.DP buňky rekombinují svůj alfa řetězec, a produkují hotový αβ-TCR protein. Tento vysoce variabilní proces genetické rekombinace umožňuje organismu vytvořit miliony T lymfocytů s rozdílnými TCR proteiny, které mohou odpovědět na téměř jakýkoli potenciální patogen. V brzlíku poté prochází v rámci svého dalšího vývoje pozitivní a negativní selekcí, aby bylo rozhodnuto, zda jsou jednak efektivní, jednak bezpečné pro tělu vlastní buňky.
Selekce
Pozitivní selekcí, probíhající v cortexu brzlíku, prochází DP buňky jako první. Ty, které projeví příliš slabou afinitu k antigenům presentovaným antigen prezentujícími buňkami (APC) jsou vyhodnoceny jako neefektivní a dochází u nich k buněčné smrti.
Negativní selekcí prochází tymocyty poté, co doputují z kůry brzlíku do vnitřní vrstvy (medulla). Antigen presentující buňky, jako jsou makrofágové nebo dendritické buňky, prezentují DP buňkám tělu vlastní molekuly. Pokud na ně reagují příliš agresivně, dojde k jejich vyřazení a buněčné smrti. Ve chvíli kontaktu s APC dojde u DP buňky downregulací k diferenciaci na naivní CD4+ nebo CD8+ T lymfocyt. Tento proces nepřežije většina tymocytů a jen malé procento dospívá. V případě cytotoxického lymfocytu se diferencuje na CD8+ buňku.
Aktivace
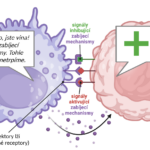
Dospělé cytotoxické T lymfocyty cirkulují tělem, zejména lymfatickým oběhem a jsou neaktivní. Pro jejich aktivaci je třeba série několika navazujících signálů.
Antigen presentující buňky jsou schopny aktivace cytotoxických lymfocytů pomocí zkřížené prezentace (anglicky cross-presentation), což je proces, při kterém APC prezentují fragmenty antigenu na svém vlastním MHC I, přestože sami nejsou nijak napadeny ani poškozeny.
Samotný kontakt antigen prezentující buňky s lymfocytem ale není dostatečný signál pro zahájení imunitní reakce. Pro kompletní aktivaci a zahájení proliferace je nutno několik sekundárních signálů. Na rozdíl od pomocných T lymfocytů není pro cytotoxické T lymfocyty natolik zásadní protein CD28, ale potřebují zejména signály od dalších kostimulačních molekul, jako je CD70 a CD137 (4-1BB). Pokud je afinita T buňky k antigenu dostatečně silná, T lymfocyt dostane pozitivní signál několika dalších molekul, jako je ICOS, OX40 a víše zmíněné CD137.
Tyto molekuly se nachází na membráně T lymfocytu a jsou stimulovány odpovídajícími ligandy, typicky se vyskytujícími na membránách APC. Na rozdíl od proteinů CD28 a TCR se molekuly ICOS, CD137 a OX40 nevyskytují na membráně lymfocytu neustále, ale jen při kontaktu s afinním antigenem. Ani antigen prezentující buňky neprodukují odpovídající ligandy neustále, ale jen při nalezení antigenu.
Tato mechanika je důležitá, protože zajišťuje, že se T lymfocyt může zaktivovat pouze v přítomnosti buněk, které nějaký antigen opravdu našly a aktivně ho prezentují. Pokud se zaktivuje bez této kostimulační zpětné reakce, může dojít k funkčnímu útlumu (tzv. anergie), nebo dokonce buněčné smrti, aby lymfocyt nemohl zahájit nevhodnou, potenciálně autoimunitní odpověď.
Aby byly vytvořeny paměťové buňky, které umožňují opakovanou stimulaci cytotoxických T lymfocytů, musí dendritické buňky interagovat s CD4+ i CD8+ lymfocyty. Během tohoto procesu získají dendritické buňky stimulaci ze strany CD4+ lymfocytů, následkem čehož mohou potentněji aktivovat CD8+ lymfocyty.
Maturace CD8+ lymfocytů je dále zprostředkována signalizačními molekulami CD40. Jakmile se naivní CD8+ lymfocyt naváže na infikovanou buňku, napadená buňka je stimulována k vypuštění CD40 molekul, jenž s podporou CD4+ lymfocytů pomáhají s diferenciací cytotoxických T buněk.
Přestože ve většině případů je aktivace lymfocytu závislá na rekognici antigenu molekulou TCR, byly popsány i alternativní způsoby aktivace. U některých CD8+ lymfocytů byla například pozorována aktivace poté, co byli účelně cíleny jinými CD8+ buňkami.
Jakmile je lymfocyt definitivně zaktivován, projde klonální expanzí za účasti cytokinu IL-2, což je růstový a diferenciační faktor pro T lymfocyty. Tímto se zvýší počet buněk specifických vůči danému antigenu, ty pak následně putují tělem a vyhledávají antigen-pozitivní somatické buňky.
Efektorové funkce

Když je lymfocyt vystaven infikované nebo jinak poškozené buňce prezentující odpovídající antigen na MHC1, vypustí několik cytotoxinů – perforin, granzymy a granulysin. Perforiny penetrují membránu cílové buňky, díky čemuž mohou do její cytoplazmy proniknout granzymy, které zde následně spouštějí kaspázovou kaskádu, což je série několika procesů vedoucí k apoptóze. Tento jev se označuje jako programovaná buněčná smrt. Samotné T lymfocyty jsou vůči vlastním perforinům rezistentní díky vysoce organizovaným lipidům a záporně nabytým fosfatidylserinům v jejich plazmatických membránách.
Druhý způsob, jakým může u cílové buňky být spuštěna apoptóza je skrze kontakt povrchů lymfocytu a buňky. Aktivovaný CD8+ lymfocyt exprimuje na své membráně protein Fas ligand (FasL)(Apo1L)(CD95L), které se mohou vázat na Fas (Apo1)(CD95) molekuly exprimované na cílové buňce. Nicméně tato Fas-Fas ligandová interakce je pravděpodobně důležitější spíše pro zbavování se vyřazených T lymfocytů během jejich vývoje v brzlíku nebo pro lytickou aktivitě některých helper T cells, než pro cytolytickou aktivitu cytotoxických lymfocytů. Kontakt Fas s FasL umožňuje interakci s multiproteinovým komplexem DISC, umožňujícím aktivaci prokaspáz 8 a 10. Ty dále aktivují efektorové kaspázy 3,6 a 7, vedoucí k nástupu substrátů jako je lamin A, lamin B1, lamin B2, PARP a DNA-PKcs. Výsledkem tohoto procesu je apoptóza buňky, která exprimovala Fas.
Předpokládá se, že transkripční faktor Eomesodermin hraje klíčovou roli ve funkci CD8+ buněk, regulující adaptivní imunitní odpověď. Studie, které se zabývali vlivem ztráty funkce Eomesoderminu zjistili, že se snížení množství tohoto transkripčního faktoru klesá i množství perforinu produkovaného CD8+ buňkami.
Role v patogenezi
Na rozdíl od protilátek, které jsou efektivní vůči virovým i bakteriální onemocněním se cytotoxické T lymfocyty uplatňují především v boji s viry.
Během onemocnění žloutenkou typu B (HBV) cytotoxické T lymfocyty zabíjejí infikované buňky a produkují cytokiny schopné zásadně poškodit i zdravé hepatocyty. Tato imunitní reakce hraje významnou roli v průběhu onemocnění a pravděpodobně zodpovídá za většinu následků spojovaných s infekcí žloutenky typu B. Krevní destičky jsou spojovány s kumulací cytotoxických T lymfocytů v infikovaných játrech.
Předpokládá se, že cytotoxické T lymfocyty hrají roli v progresi artritidy: zmenšování počtu důležitých molekul kolenních chrupavek, jako jsou mukopolysacharidy, vlivem cytotoxických lymfocytů a makrofágů byla pozorována na myším modelu.
CD8+ T buňky hrají roli při HIV infekci. HIV se v průběhu času velmi dobře adaptovalo na imunitní systém svého hostitele. Například vysoká míra mutací viru umožňuje uniknout poznávacím mechanismům CD8+ buněk. Vir také dokáže hostitelskou buňku přimět ke snížení množství exprimovaných MHC1 na povrchu membrány, což zneschopňuje CD8+ lymfocytům efektivní rozpoznání a likvidaci nakažených buněk.
Dále se ukazuje, že CD8+ lymfocyty mohou být zapojeny do onemocnění cukrovky typu 1. Studie na diabetických myších ukazují, že CD8+ lymfocyty by mohli hrát v onemocnění cílením a likvidací insulin-produkujících slinivkových buněk.
CD8+ T buňky jsou pravděpodobně nezbytné pro předcházení a léčbu CIPN, což je vedlejší efekt způsobený chemoterapeutickými léky, poškozující nervový systém. Bylo zjištěno, že myši bez CD8+ buněk mají delší CIPN v porovnání se standardními myšmi a vpíchnutí CD8+ buněk pomáhá řešit nebo dokonce předchází CIPN.