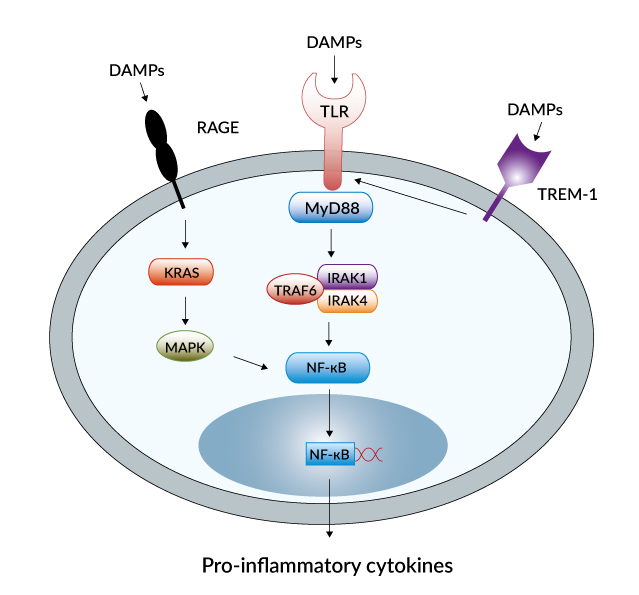
DAMPs neboli Damage (Danger)-associated molecular patterns jsou molekuly, které iniciují a zároveň udržují neinfekční zánětlivou odpověď (na rozdíl od PAMPs (Pathogen-associated molecular patterns), které zahajují a udržují infekční zánětlivou odpověď). Jsou známé také jako alarminy. Uvolňují se ze stresovaných buněk podstupujících nekrózu. DAMPs jsou často proteiny pocházející z jader či cytosolu buněk. Při jejich uvolnění z buňky či vystavení na povrchu buňky po poranění tkáně, se pohybují z redukčního do oxidačního prostředí, což způsobí jejich denaturaci. Mezi nejznámější DAMPs patří HMGB1 (high mobility group box-1), S100A8 (calgranulin A), S100A9 (calgranulin B) a sérový amyloid A (SAA). Zvýšené sérové hladiny těchto DAMPs mohou být spojeny s mnoha zánětlivými chorobami (sepse, artritida, ateroskleróza, lupus, Crohnova choroba a rakovina).
Historie
V roce 2004 poprvé Seong a Matzinger popsali DAMPs, ačkoli mnoho imunologů si už dříve všimlo mnoha různých „Danger“ signálů, které by mohly iniciovat vrozenou imunitní odpověď.
Příklady DAMPs
DAMPs se velmi liší podle typu buňky (epiteliální, mezenchymální) a poškozené tkáně. Proteinové DAMPs zahrnují intracelulární proteiny (HSP – Heat shock proteins, HMGB1) a proteiny pocházející z extracelulární matrix, jež jsou generované z poškozené tkáně (hyaluronan). Příkladem DAMPs neproteinové povahy je ATP, kyselina močová, heparin sulfát a DNA.
HMGB1
HMGB1 je prototypický leaderless secretory protein (LSP), který je vylučován hematopoetickými buňkami skrze lysozom-zprostředkovanou dráhu. Je to hlavní mediátor endotoxinového šoku a jako DAMP má vliv na buňky imunitního systému spustit zánětlivou odpověď. Receptory pro HMGB1 jsou TLR2, TLR4 a RAGE (Receptor for Advanced Glycation Endproducts). HMGB1 může indukovat maturace dendritických buněk přes upregulaci CD80, CD83, CD86 a CD11c a indukovat produkci dalších pro-zánětlivých cytokinů v myeloidních buňkách (IL-1, TNF-a, IL-6, IL-8) a také upregulovat expresi adhezivních molekul (ICAM-1, VCAM-1) na endoteliálních buňkách.
Přítomnost DNA jinde než v jádře či mitochondrii je vnímáno jako DAMP a spouští odpověď zprostředkovanou TLR9 a DAI, která řídí aktivaci buněk a imunoreaktivitu. Zajímavostí je, že některé tkáně, např. střevo, jsou inhibovány v jejich imunitní odpovědi prostřednictvím DNA. Podobně také poškozená RNA, uvolněná z keratinocytů vystavených UVB, aktivuje TLR3 na intaktních keratinocytech. Aktivace TLR3 stimuluje produkci TNF-alfa a IL-6, které iniciují zánět spojený se spálením od slunce.
S100 molekuly
S100 molekuly jsou vápník-vázající proteiny exprimované v buňkách myeloidního původu. Podílejí se na intracelulární i extracelulární regulaci.
Metabolity purinu (ATP, adenosin, kyselina močová)
ATP a adenosin se uvolňují ve vysokých koncentracích např. po nekrotické buněčné smrti. Při vyšších koncentracích ATP blokuje syntézu pro-zánětlivých cytokinů, při nižších koncentracích slouží jako chemoatraktant nezralých dendritických buněk. Kyselina močová je také endogenním danger signálem, uvolňuje se z poškozených buněk.