Diapedéza (též extravazace nebo transepiteliální migrace) je schopnost bílých krvinek(leukocytů) procházet cévní stěnou kapilár a vstoupit do tkání obklopené krevními cévami. Tento proces je významný pro vrozenou i adaptivní imunitu protože díky němu mohou imunitní buňky pronikat do míst, kde vzniká zánět např. z důvodu infekce patogenem. I z toho důvodu je proces migrace leukocytů velmi přísně kontrolován.
Diapedézy v klasickém slova smyslu jsou schopné zejména neutrofilní granulocyty a monocyty, ačkoliv podobný proces probíhá i u lymfocytů při jejich migraci mezi tkáněmi, zejména pak při tzv. homingu lymfocytů do lymfatických orgánů.
Průběh
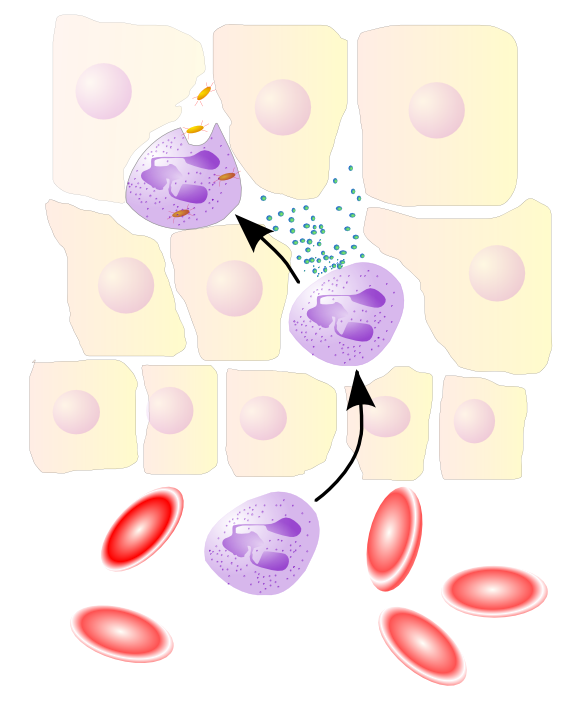
Průběh diapedézy lze rozdělit do několika základních kroků
- chemoatrakce
- adheze a rolování
- pevné navázání
- transmigrace
Chemoatrakce
Buňky endotelu (endotel) cév za normální okolností nevystavují na svém povrchu mnoho adhezivních molekul. V případě akutní infekce okolní tkáně, buňky endotelu vystaví na svém povrchu selektiny typu P a E a buněčné adhezivní molekuly (CAM) . Signálem pro vystavení těchto adhezivních molekul na povrch jsou prozánětlivé mediátory nacházající se v napadené inervované tkáni. Jsou jimi fragmenty komplementu (C5a), histaminu, leukotrien B4, TNF-α, LPS, chemokiny a další molekuly signalizující infekci. Tyto signální mediátory sekretují rezidentní imunitní buňky v napadené tkáni, žírné buňky, dendritické buňky a rezidentní makrofágy, které rozpoznaly přítomnost patogenu pomocí patogen asociovaných molekulárních vzorů (PAMP) .
Změna povrchu endoteliálních buněk vlásečnice je přímou odpovědí na zánět v tkáni a díky ní jsou cirkulující bílé krvinky schopny rozpoznat místo, ve kterém mají vystoupit z krevního oběhu do napadené tkáně. Důležitou roli v počátku diapedézy má zřejmě i vazodilatace (rozšíření cév). Díky ní se snižuje rychlost toku krve v kapiláře a bílé krvinky se snadněji dostanou do kontaktu se stěnou vlásečnic.
Adheze a rolování
Bílé krvinky se dostávají do kontaktu se selektiny na endoteliálních buňkách, což způsobí, že se začnou rolovat po vnitřní stěně kapiláry a tím zpomalují. Zároveň rolující leukocyty vnímají chemokinový gradient na stěně vlásečnice tvořený navázanými chemokiny na mezibuněčnou hmotu (extracelulární matrix). Rozpoznání chemokinu chemokinovým receptorem na leukocytu přispívá k signalizaci a následnému vystavení integrinů na povrch leukocytu. Nově vystavené integriny, např. LFA-1, VLA-4 nebo MAC-1, jsou v nízkoaffiní formě a slabě interagují s adhezivními molekulami jako je ICAM-1 nebo VCAM-1 na endoteliálních buňkách.
Různé imunitní buňky jsou vybavené různými integriny, což společně s přítomnou kombinací adhezivních molekul na endotelu limituje typy leukocytů, které dokáží do dané tkáně vstoupit.
Pevné navázaní
Integriny na leukocytech změní svou konformaci na vysokoaffiní což způsobí, že se leukocyty přestanou rolovat a pevně přilnou k endotelu.
Nejnovější studie představují koncept určitého plazení leukocytů po stěně vlásečnice, které by mělo následovat po pevném navázání a jeho cílem je naleznutí vhodného konkrétního místa pro následnou transmigraci. Ovšem specifický mechanismus tohoto procesu není plně objasněn.
Transmigrace
Následně za pomoci integrinů a adhezivních molekul jako např. PECAM1 proběhne vlastní diapedéza. Průnik bílé krvinky endotelem se děje nejčastěji paracelulární cestou, kdy leukocyt prochází mezi stěnami dvou endoteliálních buněk a překonává buněčné spoje mezi nimi. V málo četných případech dojde k průniku leukocytu transcelulární cestou, tedy průchodu leukocytu skrz samotnou endoteliální buňku. Následně leukocyt musí ještě překonat bazální membránu pod endoteiálními buňkami.
Klinický význam
Diapedéza a její regulace je ústředním procesem migrace leukocytů do tkání. Zkoumání jejích mechanismů je relevantní pro nádorovou biologii, transplantologii a farmakologii. Porozumění mechanismům transepiteliální migrace umožňuje vyvinout léčiva schopná znesnadňovat prostupu nádorových buněk do tkání a tvorbě metastáz nebo vyvinout léčbu mesenchymálními kmenovými buňkami které by byli injikovány systémově a přitom nebyly limitovány neschopností prostoupit endotelem cév z krevního oběhu.
Deficit adheze leukocytů 1
Je forma vzácné genetické poruchy charakterizovaná neschopností bílých krvinek zachytit se na endotel vlásečnice. Deficit je způsoben vrozenou poruchou integrinového řetězce β, který se nachází jak v LFA-1 tak v molekule MAC-1. Lidé postižení tímto deficitem trpí častými opakovanými bakteriálními infekcemi a špatným hojením ran, kvůli nedostatečnému vstupu bílých krvinek do tkání.