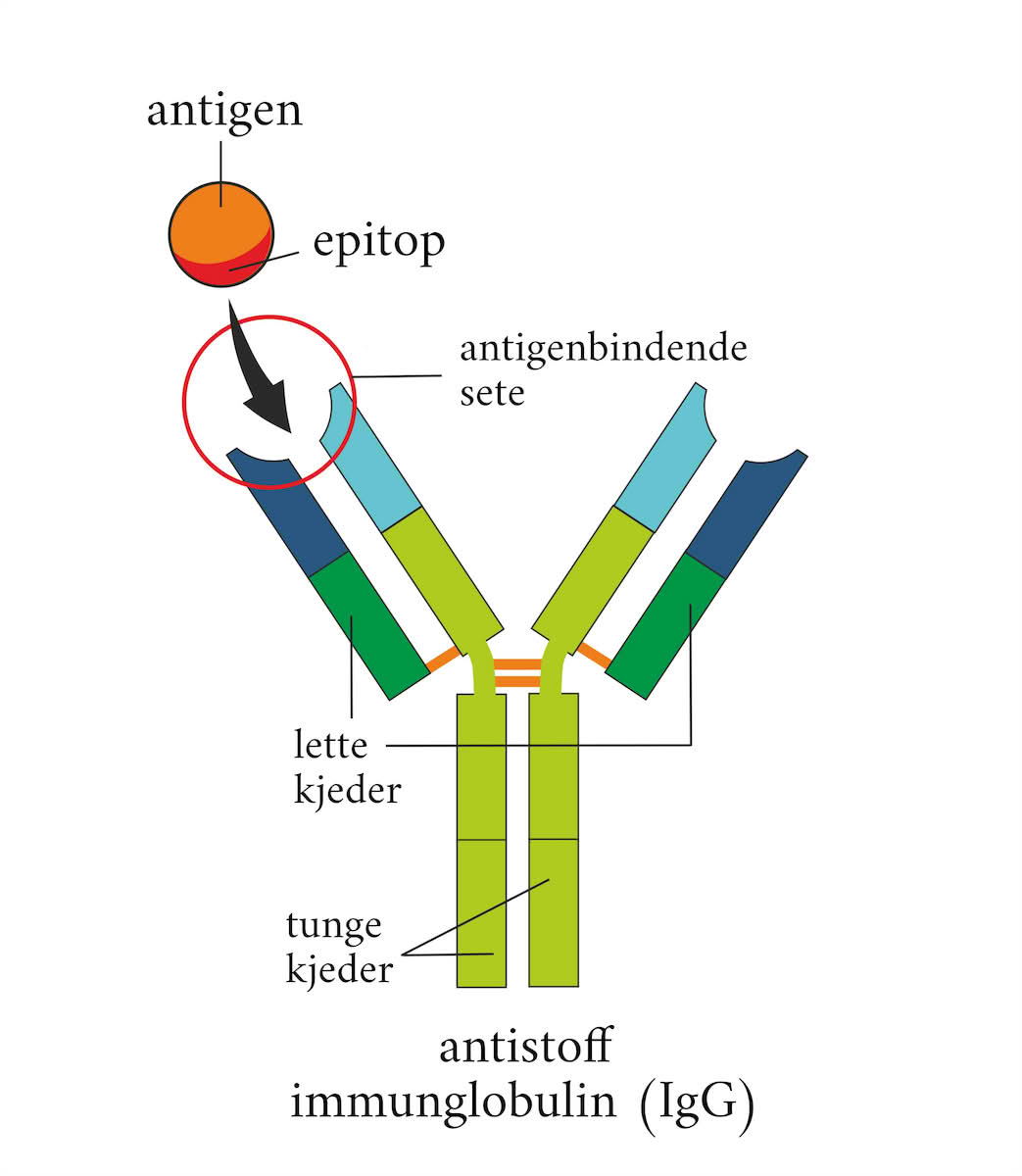
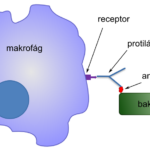
Epitop neboli antigenní determinanta je konkrétní oblast obvykle cizorodého proteinu nebo antigenu, která je schopna stimulovat imunitní odpověď. Specificky se váže na odpovídající antigenní receptor na imunitní buňce (např. B-lymfocytu) a k vazbě dochází pouze tehdy, pokud jsou struktury komplementární (vzájemně do sebe zapadají jako skládačka). Jakmile se epitop a receptor spojí, dojde ke stimulaci tvorby protilátek. Vzniklé protilátky jsou specificky zaměřeny na epitopy, které se vážou na antigenní receptory. Tímto způsobem je epitop zároveň oblastí antigenu, která je rozpoznávána specifickou protilátkou, která pak po navázání na antigen tento antigen z hostitelského organismu odstraní. Epitop je tedy klíčový pro imunitní odpověď organismu na přítomnost cizorodých látek, jako jsou viry, bakterie nebo jiné patogeny. Oblast na protilátce, která se váže na epitop, se nazývá paratop. Každá proteinová molekula obsahuje několik epitopů, tzn. několik míst, kam se vážou různé protilátky nebo antigenní receptory imunitních buněk. To umožňuje imunitnímu systému reagovat na širokou škálu patogenů velmi specifickým způsobem. Počet epitopů na molekule úzce souvisí s velikostí daného proteinu. Obecně se udává přibližně jeden epitop na 5 kDa proteinu.
Krevní sérum imunizované osoby obvykle obsahuje směs protilátek, které se mohou vázat s různými epitopy na povrchu antigenu. Protilátky, které cílí na stejný epitop, mohou mít různé schopnosti se s ním vázat. Je možné, že dva nebo více různých antigenů mají stejný epitop. V těchto případech jsou protilátky zaměřené proti jednomu antigenu schopny reagovat se všemi ostatními antigeny nesoucími stejný epitop. Takové antigeny se nazývají zkříženě reagující antigeny. V případě autoimunitních onemocnění mohou být proteiny hostitele rozpoznány imunitním systémem jako epitopy. Epitopy mají obvykle délku kolem pěti nebo šesti aminokyselin.
Studium a mapování epitopů hraje důležitou roli v lékařských vědách a je základem pro mnoho imunologických technologií. Přesné znalosti o reakcích mezi protilátkami a antigeny, které studium epitopů pomáhá objasnit, mají zásadní význam pro vývoj účinných vakcín, diagnostických testů a léčivých přípravků a také při porozumění mechanismům autoimunitních onemocnění a dalších imunologických poruch..
Typy epitopů
Existují dva hlavní typy epitopů: konformační a lineární. Tato klasifikace vychází z jejich struktury a interakce s paratopem protilátky. Konformační a lineární epitopy interagují s paratopem na základě trojrozměrné konformace, kterou epitop zaujímá a která je určena povrchovými vlastnostmi epitopu a tvarem nebo terciární strukturou ostatních segmentů antigenu.
Konformační epitop je tvořen aminokyselinami, které jsou od sebe v primární sekvenci polypeptidového řetězce oddělené, ale jsou prostorově blízko sebe ve složené, trojrozměrné struktuře proteinu. Lineární epitop je tvořen sekvencí sousedních aminokyselin v polypeptidovém řetězci. Protilátka nebo receptor rozpoznává konkrétní úsek aminokyselin, které jsou v sekvenci za sebou.
Funkce
Epitopy B-lymfocytů
Epitopy B-lymfocytů jsou specifické oblasti antigenu, které rozpoznává receptor B-buňky nebo jí produkovaná protilátka. Epitop je obvykle krátká peptidová sekvence. B-lymfocyty rozpoznávají celý nativní antigen (například virus nebo bakterii). Aby B-lymfocyt mohl antigen rozpoznat a následně se vytvořily specifické protilátky, musí se antigen nacházet na povrchu buněk.
Epitopy T-lymfocytů
Epitopy T-lymfocytů jsou části proteinů nebo jiných molekul, které jsou rozpoznávány T-buněčnými receptory. Pro imunitní systém jsou důležité, protože umožňují T-lymfocytům identifikovat a ničit patogeny nebo nádorové buňky. T-lymfocyty ale nerozpoznávají antigeny v jejich nativní formě. Antigeny musí být nejprve zpracovány antigen prezentujícími buňkami, které antigen rozštěpí na kratší fragmenty, a následně jsou prezentovány na povrchu buňky prostřednictvím molekul hlavního histokompatibilního komplexu (MHC). Epitopy T-lymfocytů jsou obvykle krátké sekvence aminokyselin, které se vážou na T-buněčný receptor.
Zkříženě reaktivní epitopy
Zkřížená reaktivita nastává, když epitopy na různých antigenech sdílejí podobné sekvence aminokyselin nebo podobnou trojrozměrnou strukturu. To znamená, že jedna protilátka nebo T-buněčný receptor může reagovat s epitopy na různých antigenech, pokud mají dostatečnou strukturní podobnost. Zkřížená reaktivita může hrát roli v rozvoji autoimunitních onemocnění. Pokud protilátka nebo T-buněčný receptor, který reaguje na cizí antigen, začne reagovat na podobný epitop na buňkách vlastního těla, může to vést k autoimunitní reakci.
Mapování epitopů
Mapování epitopů má široké využití v biomedicínském výzkumu a medicíně. Pomáhá při vývoji cílených terapií, účinných vakcín a diagnostických testů a také při porozumění mechanismům autoimunitních onemocnění a dalších imunologických poruch. Pomáhá identifikovat místo epitopu a objasnit vazebný mechanismus protilátky a umožňuje zjistit, které části antigenu jsou imunogenní (schopné vyvolat imunitní odpověď) a jakým způsobem jsou rozpoznávány imunitním systémem. Informace z mapování epitopů lze začlenit do algoritmů pro predikci epitopů B-lymfocytů na základě strukturních nebo sekvenčních údajů.
Význam pro vývoj léčivých přípravků
Ve vývoji léčiv se mapování epitopů používá při vývoji monoklonálních protilátek. Odhaluje, jakým způsobem uplatňují monoklonální protilátky své účinky, například jak zachycují protein v nefunkčním stavu nebo jak blokují vazbu ligandu.
Výzkumníci vyvíjející vakcíny proti různým patogenům využívají mapování epitopů jako nedílnou součást tohoto procesu. Patří sem nemoci, jako je ebola a horečka zika.
Metody mapování epitopů
Nejpoužívanější metodou mapování epitopů je rentgenová krystalografie, protože jejím prostřednictvím lze přímo vizualizovat interakce mezi protilátkou a antigenem. Ne všechny proteiny však lze krystalizovat a tato technika může být nákladná, časově náročná a technicky komplikovaná.
Epitopy B-lymfocytů
Mapování epitopů B-lymfocytů lze využít k vývoji terapeutických protilátek, vakcín na bázi peptidů a imuno-diagnostických nástrojů. Existují dvě základní metody mapování epitopů, strukturní a funkční:
- Metody používané ke strukturnímu mapování zahrnují rentgenovou krystalografii, NMR spektroskopii a elektronovou mikroskopii. Rentgenová krystalografie komplexů antigen–protilátka je považována za přesný způsob strukturního mapování epitopů. Nukleární magnetická rezonance nevyžaduje tvorbu krystalů, ale může fungovat pouze na malých peptidech. Elektronová mikroskopie je metoda s nízkým rozlišením, která lokalizuje epitopy na větších antigenech, jako jsou virové částice.
- Při funkčním mapování epitopů se používají ke stanovení vazby na protilátku metody Western blot, dot blot nebo ELISA . Konkurenční metody se snaží určit, zda se dvě monoklonální protilátky mohou vázat na jeden antigen současně nebo zda si konkurují ve vazbě na stejném místě. Další technologie zahrnuje rychlou mutagenezi. Tato metoda využívá k mapování epitopů náhodných lokalizovaných mutací na jednotlivých aminokyselinových zbytcích.
Epitopy T-lymfocytů
Predikce epitopů pomocí bioinformatiky předpovídá potenciální T-buněčné epitopy na základě sekvence antigenu a jeho kompatibility s MHC molekulami. Tyto predikce mohou být následně experimentálně ověřeny. Existují dva hlavní způsoby testování vazby peptid-MHC: na základě dat a struktury. Metody založené na datech poskytují vyšší výtěžnost předpovědi než metody založené na struktuře, předpovídají vazbu peptid-MHC na základě identifikace peptidových sekvencí, které vážou molekuly MHC. Metody založené na struktuře modelují strukturu vazby peptidu-MHC a vyžadují velký výpočetní výkon. Identifikací epitopů T lymfocytů mohou vědci sledovat, fenotypizovat a stimulovat T-lymfocyty.
Vakcíny na bázi epitopů
Mapování epitopů hraje klíčovou roli ve vývoji vakcín tím, že umožňuje identifikaci a charakterizaci specifických částí patogenu, které mohou vyvolat silnou a specifickou imunitní odpověď. Epitopové vakcíny využívají specifické peptidy (části proteinů) z viru, bakterie nebo jiného patogenu, aby pomohly tělu vytvořit si proti tomuto patogenu imunitu. Vakcíny jsou navrženy tak, aby cílily na určité části patogenu, které jsou pro daný patogen specifické a nenacházejí se v jiných organismech. Tímto způsobem je možné zaměřit se specificky na daný patogen.
Příkladem vakcíny založené na epitopech je vakcína proti lidskému papilomaviru (HPV). Vakcína je navržena tak, aby cílila na specifický peptid na povrchu viru HPV, který se nevyskytuje na povrchu žádného jiného viru a je důležitý pro infikování buněk virem HPV. Cílením vakcíny na zmíněný peptid si tělo může vytvořit vůči viru HPV imunitu.