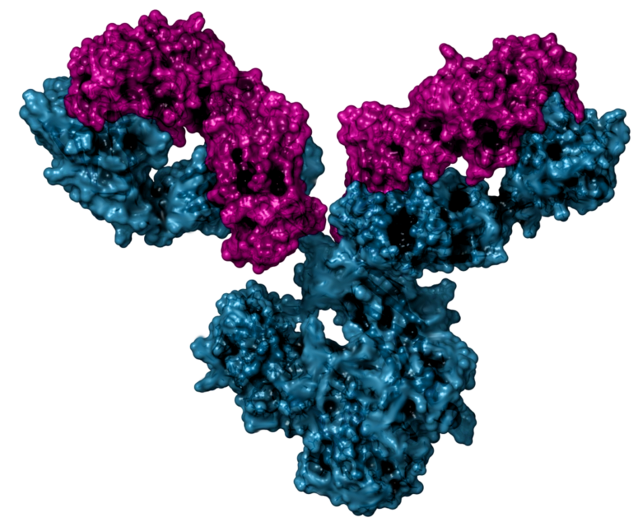
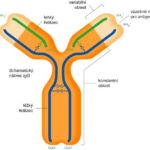
Monoklonální protilátka (mAb) je protilátka (imunoglobulin), která je získaná z klonální populacejedné plazmatické buňky. Každá plazmatická buňka (ve skutečnosti vlastně aktivovaný B-lymfocyt) v těle je schopná produkovat jistou variantu imunoglobulinu a těchto variant je obrovské množství: monoklonální protilátka je však jen jedna z těchto variant. Monoklonální protilátka má tedy přesně definovatelné vlastnostii, monovalentní afinitu a váže se pouze na stejný epitop (část antigenu, kterou protilátka rozpoznává).
Naproti tomu polyklonální protilátky se vážou na různé epitopy a obvykle je vytváří několik různých linií plazmatických buněk produkujících protilátky. Bispecifické monoklonální protilátky lze také konstruovat tak, že se terapeutické cíle jedné monoklonální protilátky zvýší na dva epitopy. Je možné vyrobit monoklonální protilátky, které se specificky vážou na téměř jakoukoli vhodnou látku, mohou pak sloužit k její detekci nebo purifikaci. Tato schopnost se stala výzkumným nástrojem v biochemii, molekulární biologiia medicíně.
Monoklonální protilátky se vyrábějí pomocí buněčných linií nebo klonů získaných ze zvířat, která byla imunizována látkou, jež je předmětem zkoumání. Pro výrobu požadované mAb jsou buňky pěstovány buď injekcí do břišní dutiny vhodně připravené myši nebo kultivací v buněčné kultuře.
Monoklonální protilátky se v poslední době v hojné míře používají k léčbě některých onemocnění (tzv. imunoterapie), jako jsou např. kardiovaskulární onemocnění, autoimunitní choroby, roztroušená skleróza, několik druhů rakoviny, nebo se jimi potlačuje reakce těla na transplantované orgány. Jsou používané také k léčbě onemocnění covid-19. Monoklonální protilátky se rovněž ve velké míře používají v diagnostických testech na přítomnost infekčních onemocnění, hormonů, toxinů, či ve výzkumu antigenů.
Historie
Na počátku 20. století navrhl imunolog Paul Ehrlich myšlenku kouzelné střely (Zauberkugel), která byla koncipována jako látka, jež se selektivně zaměřovala na organismus způsobující onemocnění a mohla mu dodat toxin. Na tom byl založen koncept monoklonálních protilátek a monoklonálních konjugátů léčiv. Ehrlich a Ilja Mečnikov obdrželi v roce 1908 Nobelovu cenu za fyziologii a lékařství za položení teoretického základu imunologie.
V 70. letech 20. století byly známy lymfocyty produkující jednu protilátku, a to v podobě mnohočetného myelomu, rakoviny postihující B-buňky. Tyto abnormální protilátky neboli paraproteiny byly použity ke studiu struktury protilátek, ale ještě nebylo možné vyrábět identické protilátky specifické pro daný antigen. V roce 1973 popsal Jerrold Schwaber výrobu monoklonálních protilátek pomocí hybridních buněk člověka a myši. V roce 1975 se Georgesi Köhlerovi a Césaru Milsteinovi podařilo provést fúzi myelomových buněčných linií s B buňkami a vytvořit hybridomy, které dokázaly produkovat specifické protilátky proti známým antigenům a byly nesmrtelné. V roce 1984 obdrželi spolu s Nielsem Kajem Jernem Nobelovu cenu za fyziologii a lékařství za teorie o specificitě ve vývoji a kontrole imunitního systému a za objev produkce monoklonálních protilátek.
V roce 1988 Gregory Winter a jeho tým jako první zavedli techniku humanizace monoklonálních protilátek a odstranili tak nežádoucí reakce, které monoklonální protilátky u některých pacientů vyvolávaly. V devadesátých letech 20. století pokročil výzkum v terapeutickém využití monoklonálních protilátek a v roce 2018 získali James P. Allison a Tasuku Hondžó Nobelovu cenu za fyziologii a lékařství za objev léčby rakoviny pomocí inhibice negativní imunitní regulace prostřednictvím monoklonálních protilátek (imunoterapie).
Translační práce potřebná k realizaci těchto myšlenek je připisována Lee Nadlerovi. V předmluvě k rozhovoru s ním se uvádí: „Jako první objevil monoklonální protilátky namířené proti antigenům specifickým pro lidské B-buňky a všechny známé antigeny specifické pro lidské B-buňky byly objeveny v jeho laboratoři. Je skutečným translačním badatelem, protože tyto monoklonální protilátky použil ke klasifikaci lidských B-buněčných leukemií a lymfomů a také k vytvoření terapeutických látek pro pacienty. . . A podstatné je také, že jako první na světě podal monoklonální protilátku člověku (pacientovi s B-buněčným lymfomem).“
Výroba monoklonálních protilátek
Vývoj hybridomů

Výrobu monoklonálních protilátek umožnil vznik hybridomů, spojení B lymfocytu produkujícího specifické protilátky a nesmrtelné myelomové buňky. Nejprve je třeba získat ze sleziny myši imunizované příslušným antigenem B lymfocyty, které produkují protilátky specifické pro požadovaný antigen. Tyto buňky se pak zfúzují s myelomovými buňkami, tj. dojde ke splynutí jejich jader a vytvoření hybridomu. Ke spojení sousedních plazmatických membrán se používá polyetylenglykol, ale úspěšnost je nízká, proto se používá selektivní médium, ve kterém mohou růst pouze fúzované buňky.
Namnožením a selekcí hybridních buněk vzniká hybridomová linie, která je nesmrtelná a produkuje protilátky určité specifity. Hybridomy lze pěstovat neomezeně dlouho ve vhodném buněčném kultivačním médiu. Mohou být také injikovány myším do břišní dutiny, kde vytvářejí nádory vylučující tekutinu (ascites) bohatou na protilátky. Obvykle se dává přednost produkci v buněčné kultuře, protože technika s ascitem je pro zvíře bolestivá. Pokud existují alternativní možnosti, je technika s ascitem považována za neetickou.
Směs buněk se pak ředí a klony z jednotlivých rodičovských buněk se pěstují na mikrotitračních jamkách. Protilátky vylučované různými klony se dále testují na schopnost vázat se na antigen pomocí metody ELISA, antigen microarray assay nebo imuno-dot blot. Nejproduktivnější a nejstabilnější klon se pak vybere pro budoucí použití.
Nové technologie
Nové technologie pro tvorbu monoklonálních protilátek zahrnují například různé metody zaměřené na jednotlivé plazmatické buňky. Na rozdíl od tradiční hybridomové technologie využívají novější technologie techniky molekulární biologie k amplifikaci genů těžkých a lehkých řetězců protilátek pomocí PCR a produkci v bakteriálních nebo savčích systémech s rekombinantní technologií. Jednou z výhod nových technologií je použitelnost pro více druhů zvířat, jako je králík, lama, kuře a další běžná pokusná zvířata v laboratoři.
Čištění
Ze získaného vzorku média kultivovaných hybridomů nebo vzorku z ascitu je třeba extrahovat požadované protilátky. Vzorek buněčné kultury může být kontaminován složkami média, jako jsou růstové faktory, hormony a transferiny. Vzorek in vivo pravděpodobně obsahuje protilátky hostitele, proteázy, nukleázy, nukleové kyseliny a viry. V obou případech mohou být přítomny další sekrety hybridomů, jako jsou cytokiny. Může docházet také k bakteriální kontaminaci a bakterie mohou vylučovat endotoxiny.
Nejprve se odstraní buňky, zbytky buněk, lipidy a sražený materiál, obvykle odstředěním a následnou filtrací pomocí 0,45 μm filtru. Tyto velké částice by v pozdějších krocích purifikace mohly způsobit zanášení membrány. Koncentrace produktu ve vzorku nemusí být dostatečná, zejména v případech, kdy je požadovaná protilátka produkována buněčnou linií s nízkou sekrecí. Vzorek se proto koncentruje ultrafiltrací nebo dialýzou.
Čištění se provádí pomocí iontově výměnné chromatografie, gelové a afinitní chromatografie. Spolu s anionty lze také separovat různé proteiny na základě jejich izoelektrického bodu (pI). Pro dosažení maximální čistoty v jednom kroku lze provést afinitní purifikaci s použitím antigenu, který zajistí specifitu protilátky.
Heterogenita protilátek
U monoklonálních protilátek a jiných rekombinantních biologických produktů je běžná heterogenita. Varianty typicky tvoří agregáty, produkty deamidace, varianty glykosylace, oxidované postranní řetězce aminokyselin a také přídavky aminokyselin a karboxylových terminálů. Tyto zdánlivě nepatrné strukturní změny mohou ovlivnit preklinickou stabilitu a optimalizaci procesu, stejně jako terapeutickou účinnost produktu, biologickou dostupnost a imunogenicitu.
K identifikaci a charakterizaci těchto často neviditelných variant se opět používá chromatografie. Získané varianty se dále hodnotí ve farmakokinetických studiích na zvířatech. Znalosti získané během preklinické fáze vývoje jsou rozhodující pro lepší pochopení kvality produktu a poskytují základ pro další strategii jeho vývoje.
Rekombinantní protilátky
Rekombinantní protilátkové inženýrství zahrnuje výrobu protilátek pomocí virů nebo kvasinek, nikoli myší. Tyto techniky využívají rychlé klonování segmentů imunoglobulinových genů a vytvářejí knihovny protilátek s mírně odlišnými aminokyselinovými sekvencemi, z nichž lze vybírat protilátky s požadovanou specifitou. Fágové knihovny protilátek jsou variantou fágových knihoven antigenů. Uvedené techniky lze využít ke zvýšení specifity, s níž protilátky rozpoznávají antigeny, jejich stability v různých podmínkách prostředí, jejich terapeutické účinnosti a jejich detekovatelnosti v diagnostických aplikacích. Pro velkoplošnou produkci protilátek se používají fermentační komory.

Chimerické protilátky
Myší a lidské protilátky jsou si sice strukturálně podobné, nicméně při aplikaci myších monoklonálních protilátek pacientům byly rozdíly mezi nimi dostatečné k vyvolání imunitní reakce a následného odstranění z krve. Docházelo také k systémové zánětlivé reakci a produkci lidských protilátek proti myším (human anti-mouse antibodies, HAMA).
Od konce osmdesátých let 20. století se výzkum zaměřuje na rekombinantní DNA, aby bylo možno prodloužit dobu působení protilátek. Při jednom z přístupů zvaném „CDR grafting“ byla myší DNA kódující vazebnou část monoklonální protilátky sloučena s DNA produkující lidskou protilátku v živých buňkách. Expresí této „chimérické“ nebo „humanizované“ DNA prostřednictvím buněčné kultury byli získány částečně myší a částečně lidské protilátky.
Lidské protilátky
Od objevu možnosti tvorby monoklonálních protilátek se vědci zaměřili na tvorbu plně humánních produktů, aby omezili vedlejší účinky humanizovaných nebo chimérických protilátek. Bylo navrženo několik úspěšných postupů: transgenní myši, fágové zobrazení a klonování jednotlivých B-buněk.
Terminologie
Název monoklonální protilátky končí vždy na -mab (z anglického monoclonal antibody). Chimérické protilátky mají koncovku -ximab, humanizované -zumab a humánní -mumab.
Náklady
Kvůli složitým procesům, celkové velikosti molekul a obrovským nákladům na výzkum a vývoj, které jsou spojeny s uvedením nové chemické substance k pacientům, je výroba monoklonálních protilátek dražší než výroba malých molekul. Jejich cena je stanovena tak, aby umožnila výrobcům získat zpět obvykle vysoké investiční náklady.
Využití
Diagnostické testy
Monoklonální protilátky se používají v laboratorních testech pro detekci specifických antigenů. Proteiny lze detekovat pomocí testů Western blot a imuno dot blot. V imunohistochemii se mAb používají k detekci antigenů ve fixovaných řezech tkání a pro jejich průkaz ve zmrazeném řezu tkáně nebo v živých buňkách se používá imunofluorescence.
V humánní medicíně jsou mAb využívány například v ELISA testech na virovou hepatitidu, AIDS nebo v těhotenských testech na přítomnost hormonu HCG. Ve veterinární diagnostice se využívají např. v imunodiagnostice Aujeszkyho choroby u prasat.
Analytické a chemické použití
Protilátky lze také použít k purifikaci cílových sloučenin ze směsí pomocí metody imunoprecipitace.
Léčebné využití
Terapeutické monoklonální protilátky působí různými mechanismy, jako je blokování funkce cílové molekuly, vyvolání apoptózy v buňkách, které exprimují cílovou molekulu, nebo modulací signálních drah.

Léčba rakoviny
Jedna z možností léčby rakoviny zahrnuje monoklonální protilátky, které se vážou pouze na antigeny specifické pro rakovinné buňky a vyvolávají proti cílové rakovinné buňce imunitní odpověď. Takové mAb lze modifikovat pro dodání toxinu, radioizotopu, cytokinu nebo jiného aktivního konjugátu nebo navrhnout bispecifické protilátky, které se mohou vázat svými Fab fragmenty jak na cílový antigen, tak na konjugát nebo efektorovou buňku. Každá intaktní protilátka se může vázat na buněčné receptory nebo jiné proteiny pomocí svého Fc fragmentu.
Mezi monoklonální protilátky používané u autoimunitních onemocnění patří infliximab a adalimumab, které jsou díky své schopnosti vázat se na TNF-α a inhibovat jej účinné u revmatoidní artritidy, Crohnovy choroby, ulcerózní kolitidy a ankylozující spondylitidy. Omalizumab inhibuje lidský imunoglobulin E (IgE) a je užitečný při léčbě středně těžkého až těžkého alergického astmatu.
Basiliximab a daklizumab inhibují IL-2 na aktivovaných T-buňkách, a tím pomáhají předcházet akutnímu odhojení transplantovaných orgánů.
Infekční nemoci
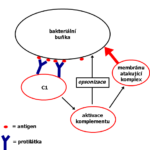
Monoklonální protilátky mohou neutralizovat viry, bakterie nebo toxiny. V některých zemích byly mAb schváleny pro léčbu nebo prevenci covidu.
Pro prevenci epizodické a chronické migrény se používá eptinezumab, galcanezumab, fremanezumab a erenumab.