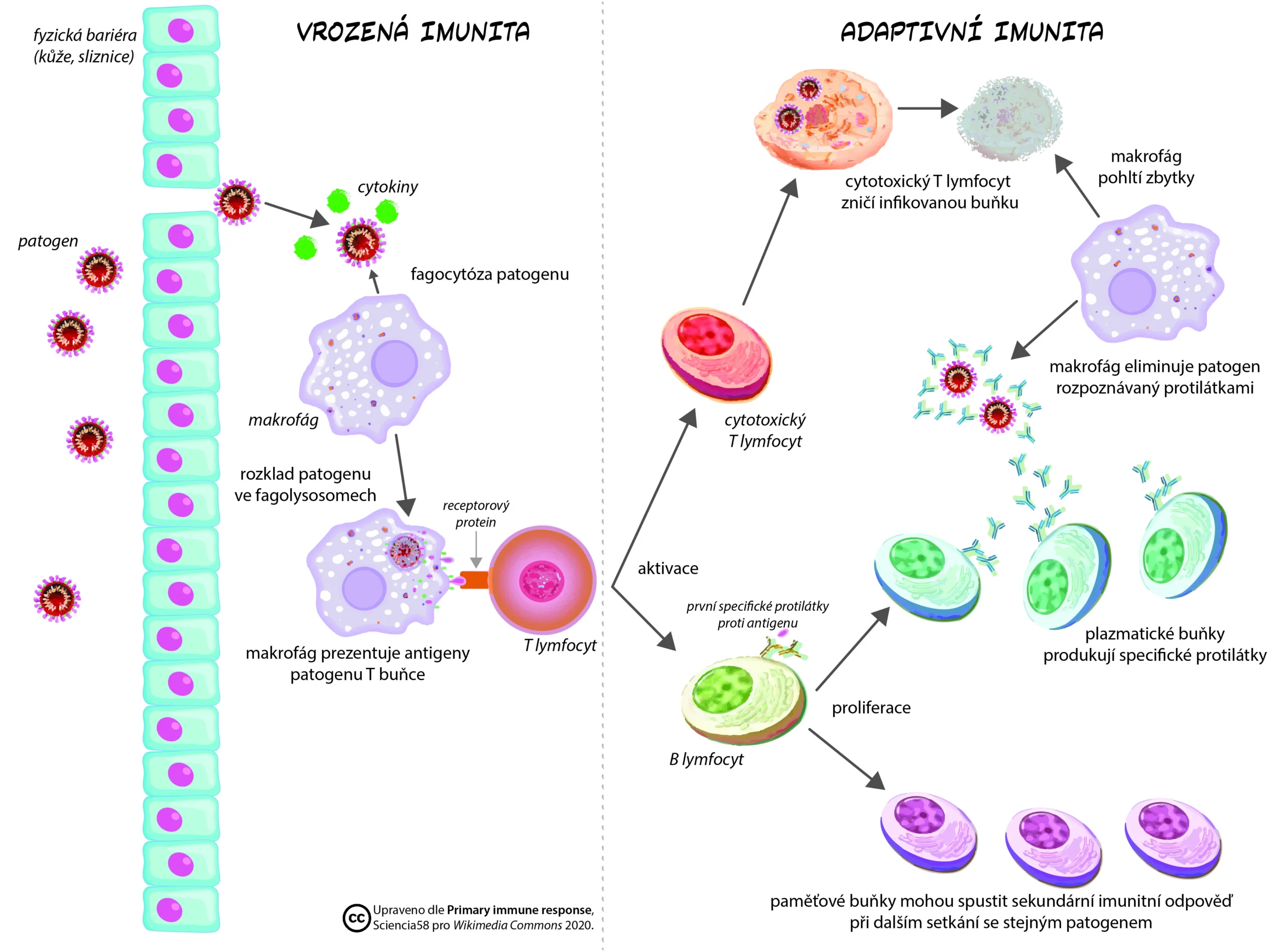
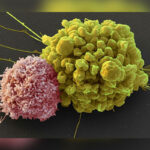
Adaptivní imunita (často nazývaná také získaná nebo specifická) vstupuje do hry v pozdější fázi infekce, kdy přítomnost molekul z patogenních mikroorganizmů (antigenů = Ag) aktivuje přes specifické antigenní imunoreceptory (TCR, BCR) příslušné klony T lymfocytů a B lymfocytů (neboli T a B buněk). Jedná se buď o celou nativní (=přirozenou) strukturu molekul pro B buňky nebo krátký naštěpený antigenní peptid na MHC komplexech pro T buňky. Když se antigenní struktura nabídne buňkám adaptivní imunity, tak dojde k buněčnému dělení příslušného T buněčného klonu (jeden z mnoha milionů T buněk v našem těle) a během tří až sedmi dní může dojít k zahájení účinné adaptivní imunitní odpovědi. Adaptivní imunita má navíc schopnost si tuto odpověď zapamatovat a budoucí imunitní odpověď je obvykle mnohem silnější a rychlejší. Tento proces, známý jako imunologická paměť, je podstatou adaptivní imunity vůči konkrétnímu antigenu, který může pocházet z patogenního mikroorganizmu. Adaptivní imunita je tedy zprostředkována zejména lymfocyty: T-lymfocyt představuje především složku buněčné imunity, zatímco B-lymfocyty jsou účinné nástroje humorální (látkové) imunity a produkují tzv. protilátky.
Znaky adaptivní imunity u hmyzu
Dlouhou dobu byla u hmyzu a ostatních bezobratlých uznávána pouze přirozená imunita. Během posledních let ovšem došlo k objevům, které pohled na hmyzí imunitu změnily. Bylo dokázáno, že hmyz je schopný zachovávat imunitní paměť a specifickou odpověď, což jsou znaky adaptivního imunitního systému. Navzdory přítomnosti těchto znaků nemůžeme ovšem u hmyzu hovořit o vysloveně adaptivní imunitě, chybí buňky adaptivní imunity a mechanismy umožňující paměť a specificitu se liší.
Imunitní paměť hmyzu byla objevena prostřednictvím fenoménu „primingu“. Pokud je hmyz vystaven velmi malé dávce nebo usmrcenému patogenu je schopný rozvinout jakousi imunitní paměť na jejímž základě je schopný při příštím setkání se stejným patogenem vydržet i jinak smrtelnou dávku. Na rozdíl od obratlovců nemá hmyz buňky adaptivního imunitního systému. Místo toho plní tuto roli hemocyty. Hemocyty fungují jako fagocyty a po primingu mají zvýšenou schopnost najít a pozřít patogen. Bylo také ukázáno, že je možné přenášet primovanou paměť z rodičů na potomky. Například u včel je v případě onemocnění královny bakteriální infekcí u nové generace dělnic zvýšena schopnost s touto infekcí bojovat. Na experimentálním modelu založeném na potemníkovi bylo také dokázáno, že je možné přenést paměť proti patogenu jak od matky, tak od otce.
Nejběžněji přijímanou teorií vysvětlující mechanismus specificity u hmyzu je teorie Dscam. Dscam jinak známý jako Down syndrome cell adhesive molecule je gen obsahující 3 imunoglobulinové domény. Alternativním sestřihem těchto domén vzniká velké množství odlišných variant. Po setkání s patogenem dochází k produkci odlišných forem Dscam. Pokud vystavíme jedince s odlišnými formami Dscam stejnému patogenu, pak přežijí jen ti jedinci s Dscam variantou odpovídající tomuto patogenu.
Další mechanismy podporující specificitu hmyzí imunity je RNA interference (RNAi). RNAi je forma antivirové imunity s vysokou specificitou. Skládá se z několika odlišných drah, které mají ovšem všechny za následek neschopnost viru se replikovat. Jednou z těchto drah je siRNA, kde je dvouvláknová RNA sestřižena na několik kusů, které slouží jako templáty pro proteinový komplex Ago2-RISC, který vyhledává komplementární virovou RNA a degraduje ji. Další drahou je miRNA, které se v cytoplazmě váže na komplex Ago1-RISC a funguje opět jako templát pro degradaci virové RNA. Poslední drahou je piRNA, kde se malá RNA váže na proteiny skupiny Piwi a kontroluje transpozóny a jiné mobilní elementy. Navzdory výzkumu zůstávají přesné mechanismy a detaily imunitního primingu a specificity u hmyzu neznámé.