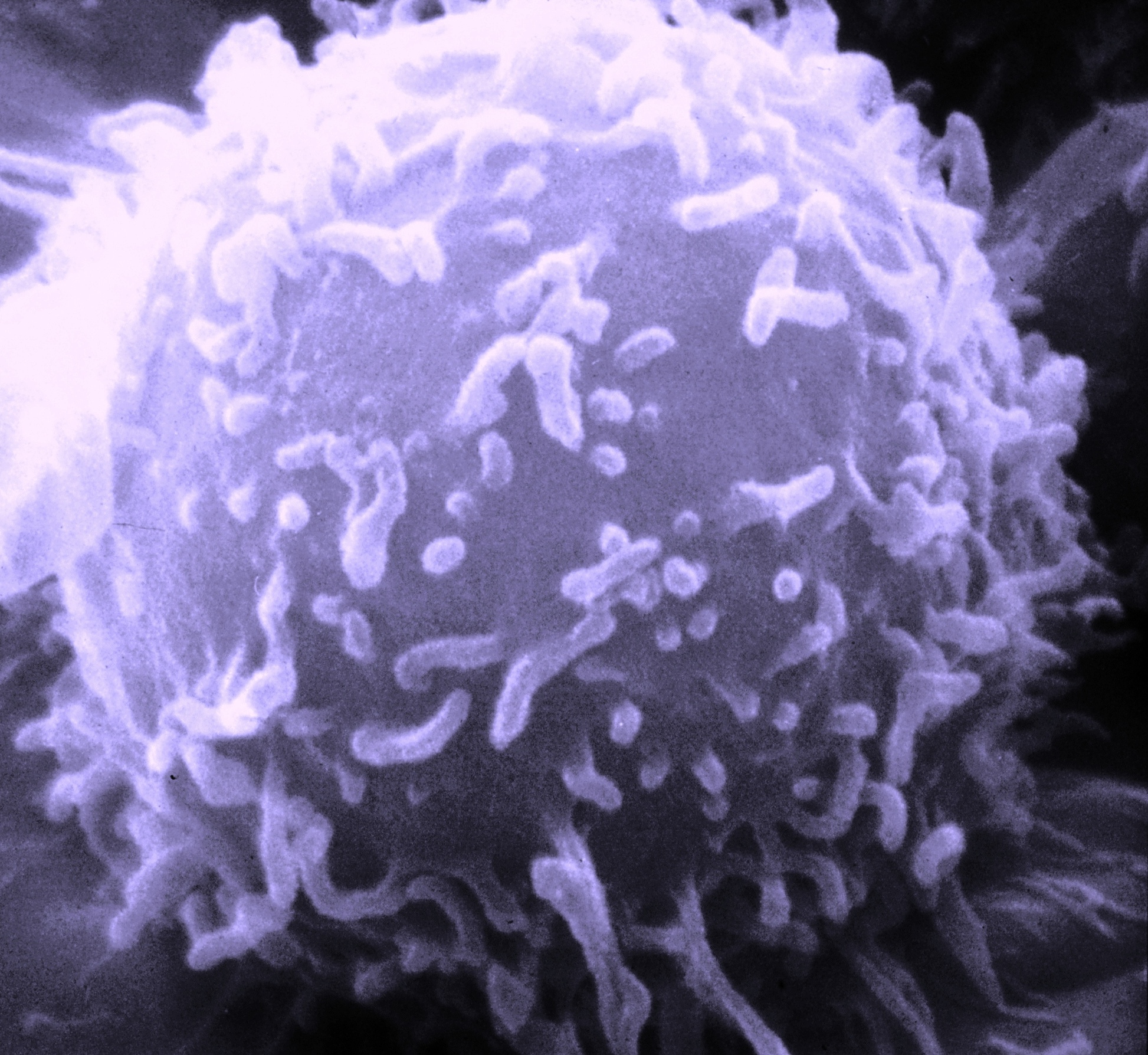
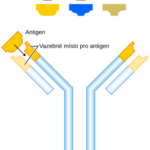
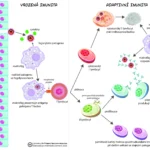
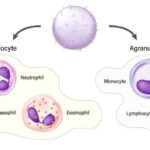
T-lymfocyt (též T-buňka) je druh bílých krvinek ze skupiny lymfocytů. Při růstu opouštějí kostní dřeň a migrují do brzlíku, ve kterém dozrávají. Existuje více typů T-lymfocytů. Obecně se však dá říci, že jsou podstatou specifické (získané) buněčné imunity, při níž potírají např. nádorové buňky či buňky napadené viry. Dále jsou některé T-lymfocyty schopné účinně regulovat imunitní systém– zejména díky tomu, že vylučují do krve cytokiny. Na povrchu T-buněk se nachází mimo jiné tzv. T-buněčný receptor a další markery (zejména CD3, dále CD8 nebo CD4).
 lidský pomocný T lymfocyt
lidský pomocný T lymfocyt
Podtypy
Existují dva základní druhy, rozlišované na základě CD markerů na povrchu:
- TH lymfocyt – pomocný T-lymfocyt, který cytokiny stimuluje imunitní reakci; dělí se především na TH1 lymfocyty („zánětové“ TH buňky, schopné i přímé aktivity) a TH2 lymfocyty (typičtí regulátoři, aktivují B-lymfocyty)
- TC lymfocyt – cytotoxický T-lymfocyt, ničí buňky napadené viry a jinými parazity a nádorové buňky; často pomocí interakce mezi FasL a FasR, což vyvolává buněčnou smrt cílových buněk
Oba tyto typy se mohou po proběhnutí primární imunitní odpovědi uchovávat v těle jako paměťové T-lymfocyty. Mimo tyto dva základní druhy byly navrženy další podtypy T-lymfocytů, které jsou vzácné nebo se jejich existence nepotvrdila:
- Treg lymfocyt (regulační T-lymfocyt, někdy též Ts – supresorové) – regulují TH– a B-lymfocyty
- NK T-lymfocyt – podobající se NK buňkám, ale mají i vlastnosti T-buněk
- γδ T-lymfocyt – mnohostranně účinkující T-buňka se zvláštním druhem T-buněčných receptorů na povrchu.
Regulace aktivit TH1 a TH2
O tom, či se budou prekurzorové CD4+ TH buňky vyvíjet směrem k TH1 nebo TH2, rozhoduje poměr dvou cytokinů, které se jmenují IL-12 a IL-4. Cytokin IL-12 je produkován makrofágy a dendritickými buňkami, které jsou stimulované některými mikroorganismy. Naproti tomu cytokin IL-4 je produkován bazofily a mastocyty. Když začne celý proces u makrofágů, bude produkován IL-12 a ten bude stimulovat tvorbu TH1. Začne-li proces probíhat u bazofilů nebo mastocytů, bude produkován především IL-4 a ten bude stimulovat vznik TH2. Cytokiny produkované TH1 buňkami (především IFN-γ) dále podporují vývoj TH1 a silně inhibují vývoj TH2. Naopak IL-4 a IL-10, které jsou produkty TH2, podporují vznik TH2 a inhibují vývoj TH1.
Imunitní reakce založené na cytotoxických T-lymfocytech
Cytotoxické T lymfocyty (Tc) jsou důležitými složkami imunitního systému. Jejich úkolem je rozeznat buňky infikované viry nebo jinými intracelulárními parazity, popřípadě jiné poškozené/abnormální buňky (například buňky poškozené stresem či nádorové buňky). Tyto buňky jsou ničeny mechanismy závislými na bezprostředním těsném kontaktu mezi Tc a napadenou buňkou. Způsob obrany je tedy velmi radikální a do značné míry i riskantní, protože poškození tkání cytotoxickými T-lymfocyty může být často mnohem horší než poškození virem, který způsobil infekci.
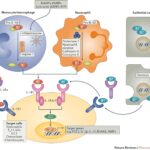
Zahájení imunitní odpovědi založené na cytotoxických T-lymfocytech probíhá následovně: prekurzor Tc musí rozeznat MHC gp I s antigenními peptidy (např. fragmenty virových proteinů) na povrchu buněk prezentujících antigen (APC). Tyto buňky musí mít patřičně adhezívní molekuly a kostimulační molekuly (CD80, CD86, ligandy receptorů CD28). Takovými APC mohu být dendritické buňky nebo makrofágy. Buňky jsou virem infikovány, nebo pohltí příslušné antigeny, které pocházejí z odumřelých infikovaných, nádorových, či stresových buněk. Když prekurzorová Tc buňka rozezná antigen na povrchu jiných buněk, které nemají stimulační vlastnosti profesionálních APC, dostane pouze první signál a to ji utlumí. Když dojde k prvnímu kontaktu na povrchu účinné APC, prekurzor Tc se začne dělit (proliferovat) a diferencovat na klon zralých efektorových cytotoxických buněk (Tc, CTL).
Aktivace T-lymfocytů superantigenem
Jako superantigeny označujeme proteiny, které mají dvě vazebná místa s odlišnou funkcí. Jedním vazebným místem interagují s epitopem přítomným na všech molekulách MHC gp II a tím druhým se strukturami sdílenými mnoha různými molekulami TCR receptoru (těmi, které používají strukturně podobné variabilní úseky). Takový superantigen může propojit MHC gp II na povrchu jakýchkoli antigen prezentující buňky s TCR přítomných na velké části T-lymfocytů. A právě tento krok dá T-lymfocytu signál podobný „normálnímu“ signálu přes TCR, který vede k rychlé aktivaci mnoha T-buněk současně a zároveň k sekreci velkého množství cytokinů, které pak mohou způsobit šokové stavy. Podobné aktivační účinky mají i některé mitogenní lektiny, jako například ConA a nebo PHA. Polyklonální aktivace T-lymfocytů lze také dosáhnout protilátkami proti TCR a nebo CD3.
Protilátková reakce vyvolaná antigeny závislými na T-lymfocytech
Specifikem protilátkových reakcí vyvolaných antigeny závislými na T-lymfocytech je, že probíhají ve dvou fázích, a to ve fázi primární a sekundární odpovědi. Tyto fáze mohou být jasně oddělené. Závisí to na dávce antigenu a způsobu jeho podávaní. Například když jsou podávány opakované malé dávky s vhodným časovým odstupem. V případe přirozené infekce, kdy v organismu přetrvává, tedy vzniká relativně velké množství antigenu po delší dobu, naopak nebude primární fáze od sekundární oddělená, ale budou na sebe bezprostředně navazovat.
Vyčerpání T buněk
T buněčné vyčerpání se projevuje nesprávnou funkcí T buněk. Vyčerpání je charakterizováno postupnou ztrátou funkce, změnami v transkripčním profilu a dlouhotrvající expresí inhibičních receptorů. Nejprve buňky přichází o schopnost produkce IL-2 a TNF-αnásleduje ztráta vysoké proliferační kapacity a cytotoxicity. V pozdějším stádiu vyčerpání mohou být T buňky deletovány. Vyčerpané T buňky mají typicky vysoké hladiny CD43, CD69 a inhibičních receptorů naopak snížena je exprese CD62L a CD127. Vyčerpání se může rozvinout během chronické infekce, sepse nebo rakoviny. Vyčerpané T buňky si zachovávají svou změněnou funkčnost i po opakovaném setkání s antigenem.
Vyčerpání může být spuštěno celou řadou faktorů jako je například přetrvávající vystavení antigenu a ztráta pomoci od CD4 T buněk. Vystavení antigenu má také efekt na průběh vyčerpání, jelikož delší vystavení nebo vyšší množství antigenu má za následek zhoršení vyčerpání. Pro rozvinutí vyčerpání je třeba kontinuální vystavení antigenu po dobu alespoň 2-4 týdnů. Dalším faktorem schopným vyvolat vyčerpání jsou inhibiční receptory jako protein PD1, CTLA-4, TIM-3 nebo LAG3. Rozpustné molekuly jako jsou cytokiny IL-10 a TGF-β mohou také vyvolat vyčerpání. Posledním známým mechanismem vyvolání vyčerpání jsou regulační T buňky. Ty mohou být zdrojem již zmiňovaných cytokinů a mohou proto hrát roli ve spuštění vyčerpání. Kromě toho bylo ukázáno, že po odstranění Treg a blokaci PD1 dochází k neutralizaci vyčerpání. Vyčerpání T buněk se také může objevit během sepse, jako následek cytokinové bouře. Po prvotní fázi sepse dojde k produkci protizánětlivých cytokinů a pro-apoptotických proteinů, aby nedošlo k poškození těla. V tomto prostředí dochází k rozvoji vyčerpání. V nedávné době vyšlo několik studií, které nastínily možnost využití blokace inhibičních receptorů v boji se sepsí.
Vyčerpání během transplantace
Během infekce se vyčerpání rozvíjí díky dlouhodobému vystavení antigenu, podobná situace nastává i po transplantaci v případě antigenů ze štěpu. Bylo ukázáno, že reakce T buněk proti štěpu, v případě transplantace ledvin, se v průběhu času zeslabuje. Tyto data ukazují, že vyčerpání T buněk hraje důležitou roli v toleranci štěpu díky deleci aloreaktivních CD8 T lymfocytů. Několik studií dále ukázalo pozitivní vliv chronické infekce na přijetí štěpu a jeho dlouhodobé přetrvání právě vlivem vyčerpání T buněk. I přes existenci dat ukazujících na pozitivní vliv T buněčného vyčerpání během transplantace existují nevýhody. Mezi tyto nevýhody by se dalo počítat například zvýšené množství infekcí nebo náchylnost ke vzniku nádoru.
Vyčerpání během rakoviny
Během rakoviny hraje vyčerpání T buněk roli v ochraně nádoru. Podle výzkumu jsou některé buňky s nádorem spojené, ale i samotné buňky nádoru, schopny aktivně indukovat vyčerpání T buněk. Vyčerpání může také hrát roli v případě relapsů, jak bylo ukázáno například na případu leukémie. Jedna studie dokonce předložila důkazy o možném využití exprese blokačních receptorů PD-1 a TIM-3 na T buňkách pro odhad pravděpodobnosti relapsu u leukémie. V posledních letech probíhá mnoho experimentů a klinických studií s blokátory inhibičních receptorů a jejich možného využití při léčbě rakoviny. Některé z nich byly uznány jako fungující a jsou nyní jednou z možností terapie pro některé druhy nádorů. Inhibiční receptory cílené těmito léčivy jsou důležité během vzniku a udržení vyčerpání T buněk a jejich zablokování má za následek obnovení funkcí vyčerpaných T buněk.