G protein

G proteiny jsou rodinou GTPáz důležitých ve vnitrobuněčné signalizaci. Existují u nich dvě konformace: „zapnutá“, jsou-li navázány ke GTP, a „vypnutá“, mají-li navázán GDP. Přepínání mezi těmito stavy je zprostředkováno GEF (guanine nucleotide–exchange factor), proteiny, které katalyzují disociaci GDP z G proteinu; k vazbě GTP pak dochází samovolně v důsledku jeho vyšší koncentrace v cytoplazmě. Změna konformace vyvolaná vazbou GTP umožňuje G proteinu aktivovat další proteiny buněčných signálních kaskád. Rychlost hydrolýzy GTP závisí mj. na aktivitě GAP(GTPase-accelerating protein) proteinů, které mohou také reagovat na extracelulární signály.
Za objev a popsání funkce G proteinů obdrželi v roce 1994 Alfred G. Gilman a Martin Rodbell Nobelovu cenu za fyziologii a medicínu. Gilman a Rodbell se původně snažili vysvětlit mechanismus stimulace buněk adrenalinem. Zjistili, že cytosolické enzymy, jako např. adenylátcykláza, nejsou aktivovány receptorem přímo, ale prostřednictvím G proteinu, který je receptorem aktivován, a může adenylát cyklázu stimulovat k produkci druhého posla, cyklického AMP.
Signalizace
Existují dvě odlišné třídy G proteinů: heterotrimerické (velké) G proteiny, aktivované GPCR (G–protein-coupled receptor) receptory, sestávající z α (alfa), β (beta) a γ (gama) podjednotek a monomerické G proteiny patřící do rodiny Ras malých GTPáz. Malé GTPázy jsou monomerické proteiny sekvenčně homologické α-podjednotce heterotrimerických G proteinů.
Heterotrimerické G proteiny

Heterotrimerické G proteiny jsou v neaktivním stavu asociovány se specifickými membránovými receptory. Skládají se z podjednotek Gα; a těsně svázaných Gβγ. Po vazbě ligandu na receptor dochází k jeho konformační změně a je schopný katalyzovat (podobně jako GEF) výměnu GDP navázaného na Gα podjednotce asociovaného G proteinu za GTP. Jakmile došlo k vazbě GTP, komplex Gα•GTP disociuje od Gβγpodjednotky, oba komplexy však zůstávají vázané v membráně, neboť Gα a Gγ podjednotky mají kovalentně vázaný lipidový řetězec (myristoylový, palmitoylový nebo prenylový zbytek), pomocí nějž jsou v membráně zakotveny. Gα s navázaným GTP může aktivovat efektorové proteiny, dokud nedojde k hydrolýze navázaného GTP na GDP. Gα podjednotka je sama GTPázou, a je tak schopná katalyzovatvlastní inaktivaci. Hydrolýzu může ještě urychlit protein RGS (regulator of G protein signaling), čímž se zkracuje doba, po kterou může Gα podjednotka aktivovat efektorové proteiny. Po hydrolýze GTP se inaktivovaná Gα podjednotka rychle opět asociuje s Gβγ.
Malé GTPázy
Malé GTPázy vážou podobně jako heterotrimerické G proteiny GDP a GTP a jsou zodpovědné za přenos signálu v buňce. Na rozdíl od heterotrimerických G proteinů existují jako monomery a k žádné disociaci po aktivaci tedy nedochází – fungují jako samostatná Gαpodjednotka heterotrimerických G proteinů. Do této třídy patří důležité regulační proteiny, zejména z pěti rodin:
- Ras rodina
- Rho rodina
- Rab rodina
- Arf/Sar rodina (Arf, Sar)
- Ran rodina
U člověka je 170 zástupců (proteinů).
Podjednotky
Gs alfa podjednotka
Gi alfa podjednotka
Gq alfa podjednotka
Pojem naleznete v následujících článcích:
-
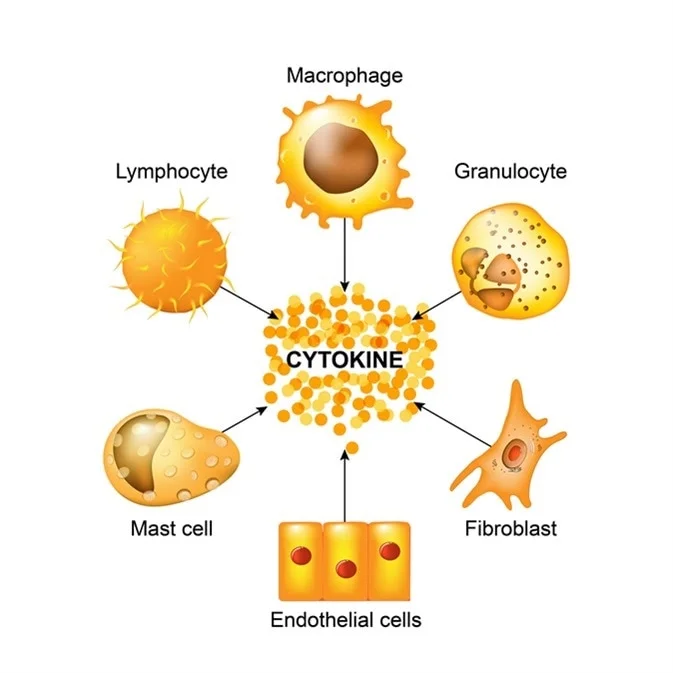
Cytokin
Interleukin-1 α interleukin (Interleukin 1-receptor – IL1R (ružově) a Interleukin 1-beta komplex – IL1B(azurově) Cytokin (podobný termín interleukin) je označení pro skupinu menších signálních proteinů, účastnících se významně…
-
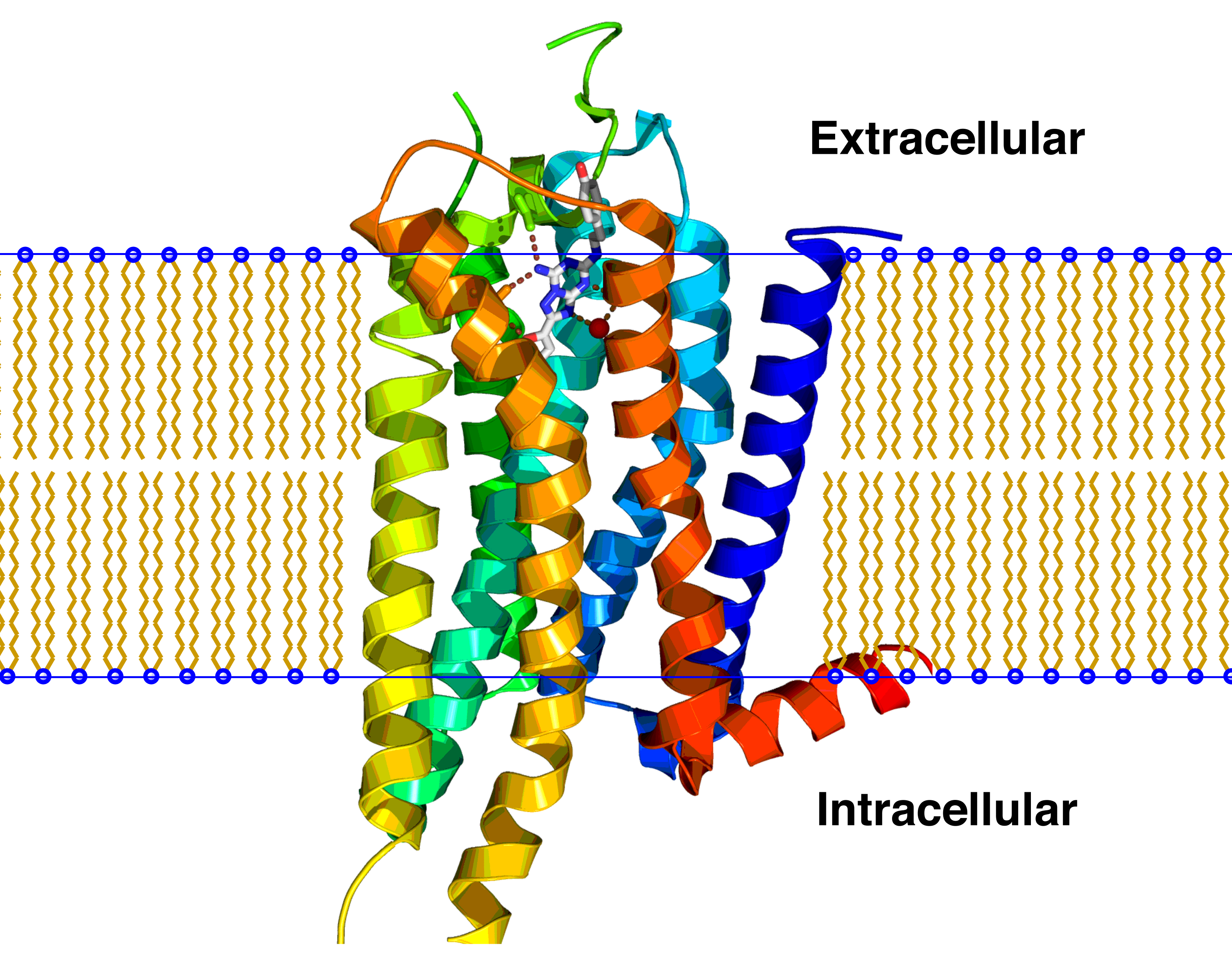
Receptor
Trans-membránový receptor: E: vnější mezibuněčný prostor, P: cytoplazmatická membrána, I: vnitrobuněčný prostor V biochemii je receptor (přijímač, přenašeč) bílkovina umístěná na cytoplazmatické membráně nebo v cytoplazmě či v buněčném jádře, která…