Anergie je imunologický pojem, který popisuje neschopnost reakce lidského imunitního systému proti cizí látce zapříčiněnou přímou indukcí tolerance v periferních lymfocytech. Imunitní systém je v případě anergie neschopný reakce proti určitému antigenu, většinou autoantigenu. Lymfocyty jsou považovány za anergické v případě, když nejsou schopny reagovat na antigen, vůči kterému jsou specifické. Anergie je jeden ze tří procesů, které způsobují toleranci, čímž zabraňují sebepoškození organismu imunitním systémem. Ostatními jsou klonální delece a imunoregulace.
Mechanismus
Tento fenomén by poprvé popsán Gustavem Nossalem u B lymfocytů a pojmenován „klonální anergie„. Klony anergizovaných B buněk v tomto případě mohou být nalezeny v krevním oběhu živé, ač neschopné vyvolat účinnou imunitní odpověď – podobný proces v T lymfocytech byl později popsán Ronaldem Schwartzem a Marcem Jenkinsem. Zdá se, že mnoho virů (například HIV) využívá mechanismy nastolení tolerance k tomu, aby se vyhly imunitní odpovědi proti nim. Ačkoliv strategie nastolení tolerance specifických antigenů je využívána méně patogeny (například bakterií lepry).
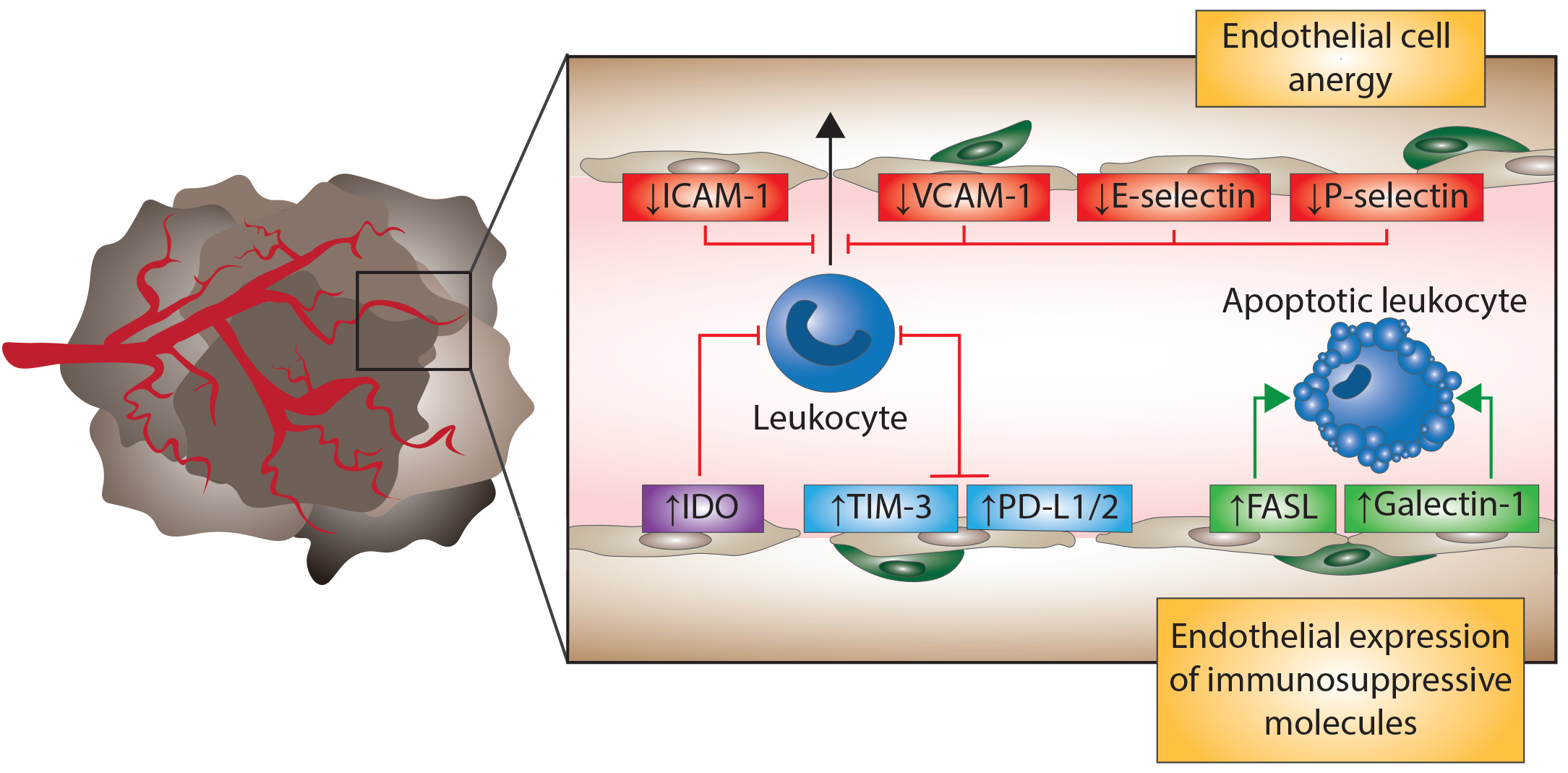
Na buněčné úrovni je anergie neschopnost určitých imunitních buněk podílet se na imunitní odpovědi proti konkrétnímu cíli. V imunitním systému je primární obrana proti patogenním virům, bakteriím nebo mnohobuněčným parazitům zajištěna buňkami zvanými lymfocyty. Existují dva základní druhy lymfocytů – T buňky a B buňky. Mezi miliony lymfocytů v lidském těle jich může být jen několik specifických k určitému infekčnímu agens. Při infekci se tyto specifické lymfocyty pomnoží – dojde k procesu „klonální expanze“, což umožňuje tělu rychle mobilizovat armádu specifických lymfocytů, když jsou potřebné. Tento systém imunitní odpovědi je „anticipační“ a jeho specificita je zajištěná preexistujícími buňkami, které při reakci na určitý antigen klonálně expandují (dochází tak ke klonální selekci). Tato specifická armáda klonů pak bojuje s příslušným patogenem dokud se v těle vyskytuje. Po vyčistění těla od patogenů většina již nepotřebných klonů přirozeně zemře.
Několik málo těchto preexistujících lymfocytů jsou však schopné reagovat proti proteinům, které se ve zdravém lidském těle vyskytují přirozeně. Klonální expanze těchto lymfocytů může vést k autoimunitnímu onemocnění, při kterém tělo zaútočí na své vlastní struktury. Aby se tomuto procesu zabránilo, mají lymfocyty mechanismus kontroly kvality, který těmto patologickým lymfocytůmzabrání v expanzi, jedná-li se o expanzi v reakci na přirozené proteiny těla. Anergie T lymfocytů nastává, když T buňka neobdrží příslušnou kostimulaci při reakci na určitý antigen. Anergie B lymfocytů může být vyvolaná vystavením B-buněk rozpustným antigenům v oběhu a je často spojená se snížením exprese povrchových IgM a částečným zablokováním buněčné signalizace anergizovaného lymfocytu.
Molekulární mechanismus vyvolání anergie v T lymfocytech
Stimulace T buněčného receptoru (TCR) zároveň s kostimulačními receptory naivního T lymfocytu vyvolá vyrovnanou spoluaktivaci všech signálních drah T-buňky (úplná stimulace T buňky). V tomto případě, mezi jinými dráhami, se aktivuje také na vápníku závislé rameno lymfocytární signalizace indukované právě signálem z T buněčného receptoru. Toto vede k růstu buněčné koncentrace Ca+II. Na vápníku závislá fosfatáza kalcineurin pak odstraní fosfátové skupiny z transkripčního faktoru NFAT, který se pak přesune do jádra.
Kromě této dráhy se v případě plné stimulace T-buněk aktivuje PI3K prostřednictvím kostimulačního receptoru CD28, což v konečném důsledku vede k zvýšení koncentrace transkripčních faktorů rel, NF-κB a AP-1 do jádra, a to ve větší míře než při stimulaci pouze TCR. AP-1, heterodimer složený z c-Fos a c-jun v jádře dále heterodimerizuje s NFAT, čímž dojde k vytvoření transkripčního komplexu, který pak zapíná expresi genů spjatých s produktivní odpovědí T-buňky. Takové geny kódují například IL-2 nebo jeho receptor.
Naopak stimulace pouze TCR bez kostimulačních receptorů dostatečně aktivuje pouze „vápníkové“ rameno T-buněčné signalizace. Ačkoliv bez indukce AP-1 ostatními drahami není NFAT schopen tvořit s AP-1 transkripční komplex, jak se děje při úplné stimulaci spjaté s produktivní odpovědí. V tomto případě NFAT homodimerizuje sám se sebou, čímž vytváří rovněž transkripční faktor, který však v tomto případě způsobuje anergii.
Homodimery NFAT jsou přímo zodpovědné za expresi genů spojenými se stavem anergie, například ubikvitin ligázy GRAIL nebo proteázy kaspázy 3. V anergizovaných T-buňkách také dochází ke snížení exprese Interleukinu-2, TNF a IFNγ, které jsou typické pro produktivní odpověď. Anergizované buňky produkují protizánětlivé cytokiny jako IL-10.
V T lymfocytech se nacházejí 3 NFAT proteiny: NFAT 1, 2 a 4. Tyto jsou očividně do jisté míry redundantní.
K produktivní odpovědi tedy dojde, když je antigen prezentován T-buňce prostřednictvím antigen prezentující buňky (APC), která prezentuje antigen na svém MHC II komplexu a která zároveň aktivuje kostimulační receptory T-buňky. Když však T-buňka interaguje s antigenem, který není prezentován na APC, což je ve většině případů antigen, vůči kterému je vyvolání imunitní odpovědi nežádoucí, dojde k anergizaci takové T-buňky. Bylo rovněž ukázáno, že i některé antigeny prezentované na APC vyvolávají aktivaci T-buňky pouze slabě. Takovýto slabý stimul je stále schopný aktivovat NFAT, avšak AP-1 již ne. Takto dochází k nastolení anergického stavu i když došlo ke kostimulaci. Silná stimulace T-buněk Interleukinem-2 nebo svým T-buněčným receptorem je schopná anergický stav prolomit.
Klinický význam
Anergie je možno využít terapeuticky. Imunitní odpověď proti transplantovaným orgánům a tkáním může být minimalizována bez oslabení celého imunitního systému, což je vedlejším efektem imunosupresiv – například cyklosporinu. Navození anergie může rovněž sloužit k omezení poškození při autoimunitních onemocněních jako diabetes mellitus, vícečetná skleróza a revmatoidní arttritidy. Naopak zábrana anergie může pomoci v případě nádorového onemocnění. Mechanismus anergie je také možné využít proti alergiím.
Dominantní tolerance
Dominantní a recesivní tolerance jsou formy periferní tolerance (kromě periferní tolerance existuje ještě tolerance centrální). Takzvaná recesivní tolerance je forma tolerance spjatá s anergizací lymfocytů, která byla popsána výše. Dominantní tolerance spočívá v aktivitě specializovaných regulačních lymfocytů, T reg buněk, které působí tlumivě na imunitní odpověď. Regulační T-lymfocyty se vyvíjejí z naivních T-lymfocytů. Podobně jako u recesivní tolerance, signalizace vedoucí pouze k aktivaci NFAT, je důležitá k vývoji T regů. V tomto případě homodimer NFAT indukuje expresi jiného transkripčního faktoru, FOXP3, který je marker T-regů a podílí se na aktivaci jejich genetického programu.
Testování
Systém „Multitest Mérieux“ nebo „CMI Multitest“ (Multitest IMC, Istituto Merieux Italia, Řím, Itálie) je používán k ověření úrovně buněčné imunity. Je to intradermální test reaktivity kůže (podobný tuberkulinovému testu), ve kterém se kontrolní glycerol používá se sedmi antigeny bakteriálního nebo houbového původu toxoid tetanu, tuberkulin, záškrt, streptokok, kvasinka, Trichophyton a bakterie Proteus. V tomto testu jsou reakce posuzovány podle počtu antigenů, které vyvolávají reakci, a podle celkového rozsahu reakce proti všem sedmi antigenům. V tomto případě je anergie definovaná jako reaktivita kůže v rozmezí 0-1 mm, „hypoergie“ v rozmezí 2-9 mm v reakci na méně než na tři antigeny, „normoergie“ v rozmezí od 10-39 mm nebo reakce na tři a více antigenů a „hypoergie“ v rozmezí 40 a více mm v reakci na méně než 4 antigeny.
Experimentální přístupy ke studiu anergie
Ke studiu anergie mohou být použity různé chemikálie aktivující/blokující popsané signální dráhy T-buňky. Anergie může být u T lymfocytů vyvolaná ošetřením ionomycinem, ionoforem schopným zvýšení koncentrace Ca+II v buňce uměle.
Naopak chelatační látky jako EGTA mohou absorbovat vápenné ionty, čímž dojde k zamezení anergie. Zablokovat dráhy vedoucí k anergii lze také cyklosporinem, který je schopen inhibice kalcineurinu, fosfatázy, která odstraňuje fosfátové skupiny z NFAT, čímž dochází k jeho aktivaci.
PMA spolu s ionomycinem lze použít k vyvolání úplné aktivace T-lymfocytu napodobením signalizace přirozeně spouštěné aktivací TCR a kostimulačních receptorů.